Czym są nowotwory tkanki łącznej i tkanek miękkich?
Pierwotne nowotwory tkanki łącznej i tkanek miękkich są to tak zwane mięsaki. Słowo to jest ogólnym określeniem nowotworów złośliwych wywodzących się z tkanki innej niż nabłonkowa. Wynika z tego bardzo duża różnorodność tej grupy. Mięsaki mogą rozwinąć się z tkanek różnego typu, np. tkanki kostnej, z tkanek miękkich, np. tłuszczowej, mięśniowej, nerwowej, czy też z utkania naczyń krwionośnych i limfatycznych.
Średnia zachorowalność na mięsaki tkanek miękkich wynosi 1–3 osób na 100 tysięcy ludności na rok. W Polsce notuje się około 800–1000 nowych zachorowań rocznie. Mięsaki tkanek miękkich mogą wystąpić w każdym przedziale wiekowym, częściej u osób w starszym wieku, ze szczytem zapadalności około 50. roku życia. Stanowią 10% nowotworów złośliwych u dzieci i tylko 1% u dorosłych.
Podstawą postępowania u chorych na mięsaki jest właściwe rozpoznanie histopatologiczne (czyli badanie mikroskopowe struktury guza) oraz wielodyscyplinarne podejście do chorego z udziałem patologów, biologów molekularnych, radiologów, chirurgów, radioterapeutów oraz onkologów klinicznych. Leczenie chorych na mięsaki tkanek miękkich powinno być prowadzone w ośrodkach o dużym doświadczeniu klinicznym, z dostępem do wysokospecjalistycznych procedur diagnostycznych i możliwością zastosowania leczenia skojarzonego składającego się z wielu zaawansowanych metod.
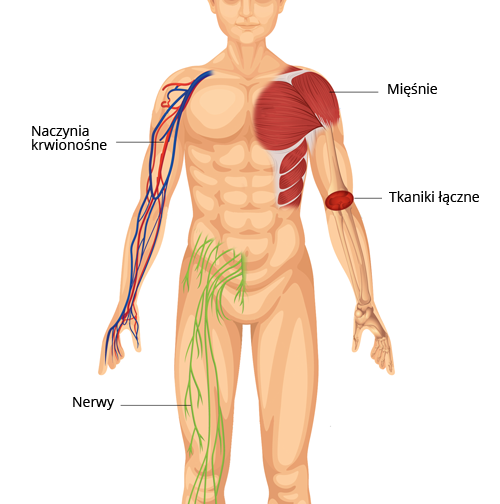
Ryc. Schematyczne przedstawienie tkanki łącznej i tkanek miękkich w organizmie człowieka