Czym jest rak jądra?
Jądro (zwane również gonadą męską) to parzysty narząd w prawidłowych warunkach mieszczący się u mężczyzn w mosznie tj. skórnym worku okolicy męskiego krocza. Jądra w rozwoju płodowym powstają w obrębie jamy brzusznej, następnie przemieszczają się w dół do moszny. Zaburzenie tego procesu schodzenia jąder do moszny skutkuje tak zwanym wnętrostwem, kiedy jedno lub oba jądra po urodzeniu znajdują się nie w mosznie lecz wyżej (w pachwinie lub w brzuchu).
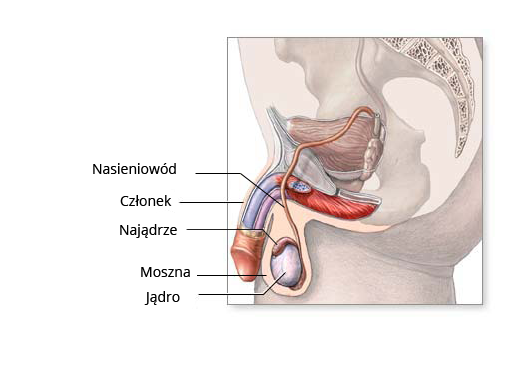
Jądra pełnią ważne funkcje w organizmie mężczyzny:
- Produkują testosteron – podstawowy hormon płciowy męski, który odpowiada za rozwój ciała w kierunku typowym dla mężczyzny. Testosteron sprzyja zachowaniu popędu seksualnego oraz powstawaniu plemników.
- Wytwarzają plemniki – są to komórki powstające w kanalikach nasiennych jądra. Z tych kanalików plemniki przedostają się do najądrza. Poprzez nasieniowód i cewkę moczową plemniki opuszczają organizm mężczyzny. Połączenie plemnika z komórką jajową kobiety to proces zwany zapłodnieniem. Jest to początek nowego życia.
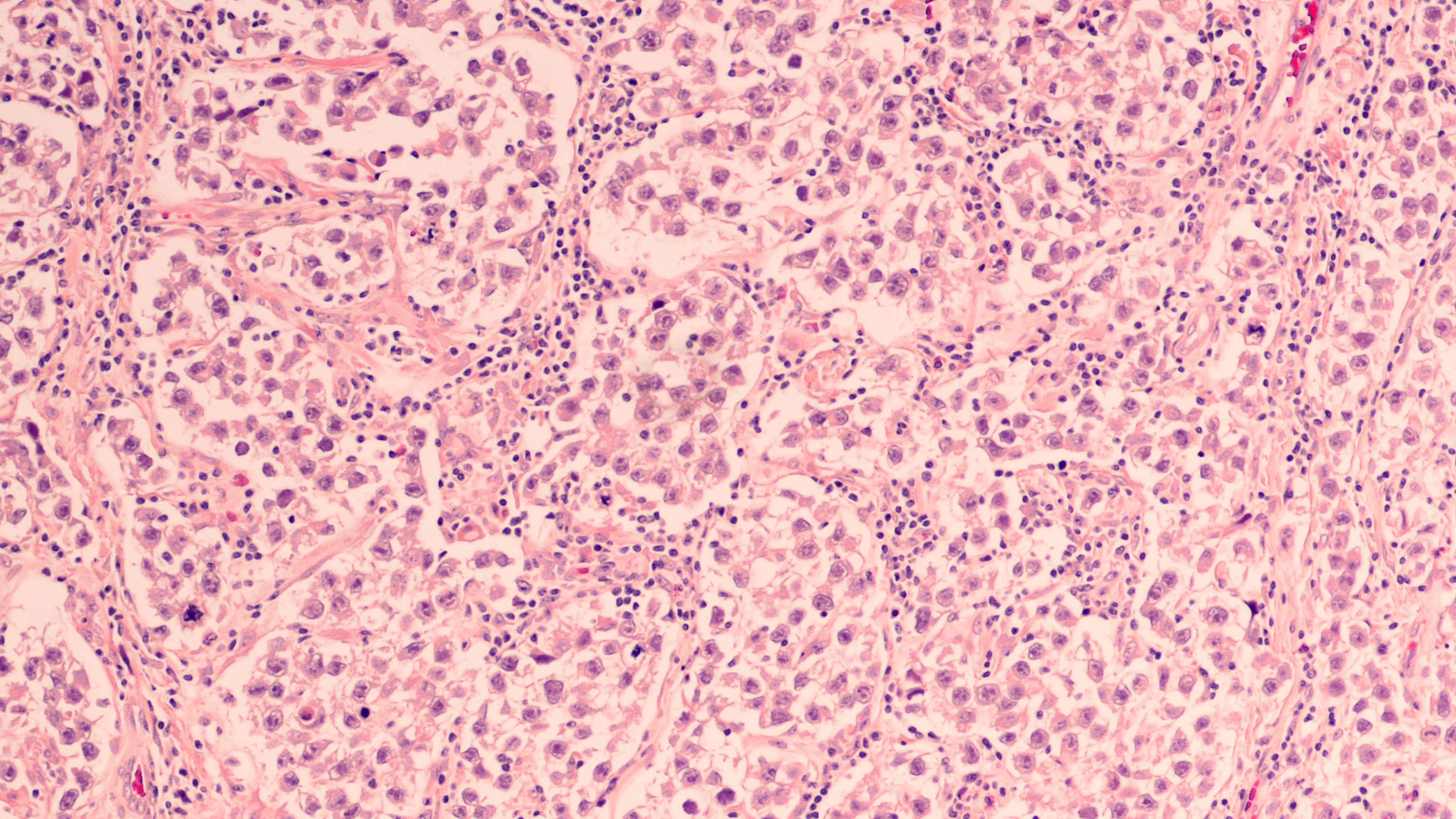
Nowotwór jądra powstaje wówczas, gdy komórka wywodząca się z jądra wymyka się spod kontroli i zaczyna się niepohamowanie dzielić, tworząc guz. W przypadku, gdy powstający guz nacieka okoliczne tkanki i niszczy je oraz gdy komórki z guza potrafią przeniknąć do naczyń krwionośnych lub chłonnych, przenieść się z krwią lub chłonką do innego narządu i tam stworzyć guz potomny – przerzut – wówczas taki nowotwór nazywamy nowotworem złośliwym. Krótko mówiąc: nowotwór złośliwy ma potencjał naciekania zdrowych tkanek i tworzenia przerzutów.
Nowotwory jądra mogą powstawać ze wszystkich tkanek jądra i mogą mieć charakter złośliwy lub niezłośliwy. Najczęściej spotykanym nowotworem jądra jest nowotwór należący do grupy nowotworów zarodkowych jądra. Cechą wspólną tych nowotworów jest to, że powstają one na skutek przekształcenia tak zwanej komórki germinalnej, z której prawidłowo powstają plemniki. Potocznie nowotwory te są nazywane rakiem jądra, choć nie jest to poprawna nazwa. Dla przypomnienia - są to nowotwory zarodkowe. Nowotwory wywodzące się z innych komórek tworzących jądro występują rzadko i przekraczają zakres niniejszego omówienia.