Konsultacja merytoryczna oraz korekta - Dr n. med. Katarzyna Pogoda
Czym jest rak piersi?
Rak piersi jest to nowotwór złośliwy powstający z komórek gruczołu piersiowego, który rozwija się miejscowo w piersi oraz daje przerzuty do węzłów chłonnych i narządów wewnętrznych (np. płuc, wątroby, kości i mózgu). Rak piersi jest najczęściej występującym nowotworem złośliwym u kobiet. Stanowi około 23% wszystkich zachorowań z powodu nowotworów złośliwych u kobiet i około 14% zgonów z tego powodu. Szacuje się, że rocznie raka piersi rozpoznaje się u 1,5 miliona kobiet na całym świecie, a około 400 tysięcy umiera z tego powodu. Jest to najczęstszy nowotwór złośliwy wśród mieszkanek krajów wysoko cywilizowanych, takich jak USA, Kanada, Australia czy kraje Europy Zachodniej. Najmniej zachorowań na raka piersi notuje się w południowej Azji i Afryce. Rak piersi, który należy do najczęstszych nowotworów złośliwych u kobiet, u mężczyzn występuje rzadko.
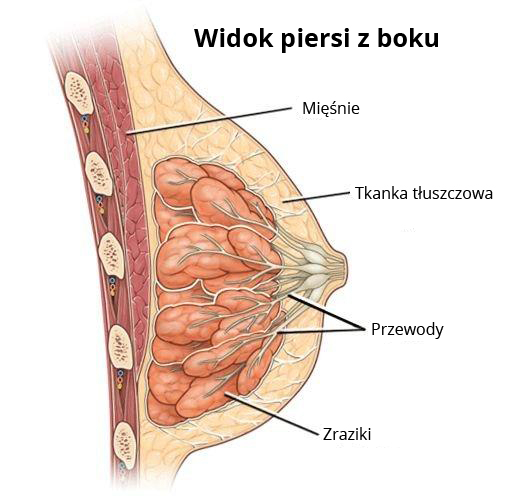
Ryc. Anatomiczny schemat piersi z boku
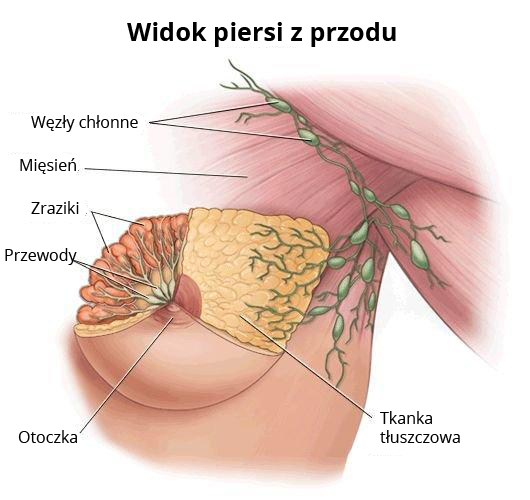
Ryc. Anatomiczny schemat piersi z przodu
Budowa piersi
Pierś kobiety zbudowana jest z 15-20 zrazików (płatów) będącymi właściwie złożonymi gruczołami pęcherzykowymi produkującymi pokarm kobiecy. Z każdego zrazika uchodzi przewód mleczny, którym pokarm kobiecy jest wydzielany do zatoki mlecznej, a następnie na zewnątrz brodawki. Zraziki i przewody są wyścielone komórkami, z których może rozwinąć się rak. Gruczoł piersiowy, zbudowany ze zrazików i przewodów, otoczony jest tkanką tłuszczową i mięśniową oraz włóknistą. Większość nowotworów piersi wywodzi się z przewodów (rak przewodowy), znacznie mniejsza część ze zrazików (rak zrazikowy). Stosunkowo rzadko nowotwory piersi mogą także rozwinąć się z innych tkanek, które wchodzą w skład budowy piersi (np. mięsaki z tkanki mięśniowej).
Układ chłonny
Najczęstszym umiejscowieniem przerzutów raka piersi w układzie chłonnym są węzły chłonne pachowe po zajętej stronie. Drugie co do kolejności zajęcia są węzły chłonne zamostkowe (węzły wewnętrznego łańcucha piersiowego). Trzecią grupą, w której mogą lokalizować się przerzuty, są węzły nadobojczykowe i znacznie rzadziej podobojczykowe.